营养与健康所尹慧勇研究组合作发现肝癌肿瘤细胞代谢影响肿瘤免疫新机制
发表时间:2023-12-08肝细胞癌(Hepatocellular Carcinoma, HCC)是世界上发病率和死亡率最高的肿瘤之一,其发病率和死亡率分别位列第六位和第四位。转化生长因子-β(Transforming Growth Factor β, TGF-β)作为肿瘤免疫微环境中重要的免疫信号分子,可以和细胞表面的TGF-β受体相结合,激活经典的SMAD信号通路以及MAPK、PI3K等其他信号通路,影响肿瘤微环境中肿瘤细胞和免疫细胞功能,在肿瘤的发生发展过程中扮演着重要的角色。在HCC的发生发展过程中,肿瘤微环境中肿瘤细胞与免疫细胞的互作影响肝癌免疫应答的分子机制仍不清楚。
果糖-1,6-二磷酸醛缩酶B(ALDOB)作为糖酵解过程中的重要代谢酶,其表达随着肝癌的发生发展而逐渐降低,ALDOB表达下调可能引起肿瘤细胞代谢重构并促进肝癌。研究组前期研究发现ALDOB表达下降可以促进磷酸戊糖途径(Pentose Phosphate Pathway, PPP) 决速酶6-磷酸葡萄糖脱氢酶(G6PD)(Li et al, Nature Cancer, 2020)和蛋白激酶AKT的活性 (He et al, Plos Biology, 2020),导致肝癌细胞的糖酵解及PPP代谢增强;同时ALDOB表达下调也可以促进胰岛素受体 (Insulin Receptor, IR) 的磷酸化及IR入核,进而上调肝癌细胞脂代谢并促进肝癌的发生发展 (Liu et al, Hepatology, 2021)。有意思的是,最近研究组与中国科学院分子细胞科学卓越创新中心高栋研究组等的一项合作研究发现GLUTI/ALDOB/G6PD 轴也影响胰腺癌的化疗效果 (Li et al, Cell Reports Medicine, 2023)。然而,肝癌肿瘤细胞ALDOB的表达如何影响肿瘤免疫微环境及具体机制仍需进一步研究。
本研究从临床样本出发,对肝癌病人的肿瘤组织进行流式细胞分析和Western Blot检测,发现ALDOB的表达和CD8+ T 细胞的浸润呈显著负相关,即肿瘤组织ALDOB的下调表达反而增加CD8+ T 细胞浸润;进一步对肝癌组织内CD8+ T细胞中的PD1、CTLA-4免疫抑制分子进行流式检测,发现这些CD8+ T细胞处于免疫耗竭的状态,提示肿瘤细胞ALDOB的表达影响肝癌免疫微环境。为了寻找ALDOB表达降低导致CD8+ T耗竭的原因,研究人员利用Aldob肝脏特异性敲除小鼠和全身敲除小鼠构建肝脏原位肿瘤模型,对小鼠肿瘤组织中的免疫细胞进行流式检测,发现在Aldob敲除小鼠的肿瘤组织中,Treg细胞数量显著增加;同时,在小鼠肝癌细胞Hepa1-6构建的皮下肿瘤模型中发现Treg细胞在Aldob敲低的皮下肿瘤组织中的数目更多。为了寻找ALDOB表达降低增加Treg细胞的原因,通过对肿瘤细胞进行转录组测序分析,发现ALDOB表达降低可以促进TGF-β的表达;体内注射Anti-TGF-β抗体可以显著缓解ALDOB表达下降而导致的Treg细胞数目增加。进一步的机制研究发现,肿瘤细胞ALDOB的表达下降可以增加细胞内组蛋白H3K9的乙酰化。通过ChIP-qPCR和CUT-TAG检测发现,ALDOB低表达可以促进TGFB1基因启动子区域的H3K9乙酰化,进而增加TGFB1的转录表达。核质分离实验表明,ALDOB可以进入细胞核与组蛋白乙酰转移酶KAT2A相互结合,进而抑制其对H3K9的乙酰化;敲低KAT2A的表达或抑制KAT2A活性均可下调TGF-β表达,提示ALDOB通过KAT2A调控TGF-β的转录表达。同时,在小鼠模型中利用Anti-TGF-b 和Anti-PD-1可以协同增加由于ALDOB下调引起的肝癌;肝癌病人ALDOB与TGF-b的表达与其预后相关。
综上,本论文发现肝癌细胞内ALDOB可以入核与KAT2A相互结合,抑制TGFB1启动子区域H3K9的乙酰化,降低TGFB1转录表达,从而降低肿瘤组织内Treg细胞的数量和维持肝癌的免疫微环境中CD8+ T细胞的功能;相反,肿瘤细胞ALDOB的丢失不仅可以通过代谢重构上调糖酵解、PPP以及TCA,生成大量的乙酰辅酶A,促进肿瘤细胞糖脂代谢,还可以解除对KAT2A活性的抑制,增加H3K9的乙酰化并上调TGF-β表达,影响CD8+ T细胞和Treg细胞的数量和功能,促进肝癌。本研究发现了糖酵解内的重要代谢酶ALDOB通过进入细胞核表观调控TGFB1基因的表达,从而影响肝癌免疫微环境免疫应答的全新分子机制,为肝癌的免疫治疗提供潜在新策略。
中国科学院上海营养与健康研究所与上海科技大学联合培养博士生阴春兆,海军军医大学附属东方肝胆外科医院张存圳为该论文的共同作者。中国科学院上海营养与健康研究所、香港城市大学生物医学系尹慧勇教授,中国科学院上海营养与健康研究所陶用珍副研究员,海军军医大学附属东方肝胆外科医院李楠主任为该论文的共同通讯作者。该研究得到了国家科技部重点研发计划、国家自然科学基金委、上海市科委和香港城市大学的基金以及深圳医学研究专项等资助,同时得到中国科学院营养与健康研究所所级公共技术中心以及缇基(北京)科技有限公司 (TG公司) 的支持。该研究还得到了中国科学院上海营养与健康研究所秦骏研究员团队及上海交通大学仁济医院内分泌科李圣贤副主任医师等的大力支持。
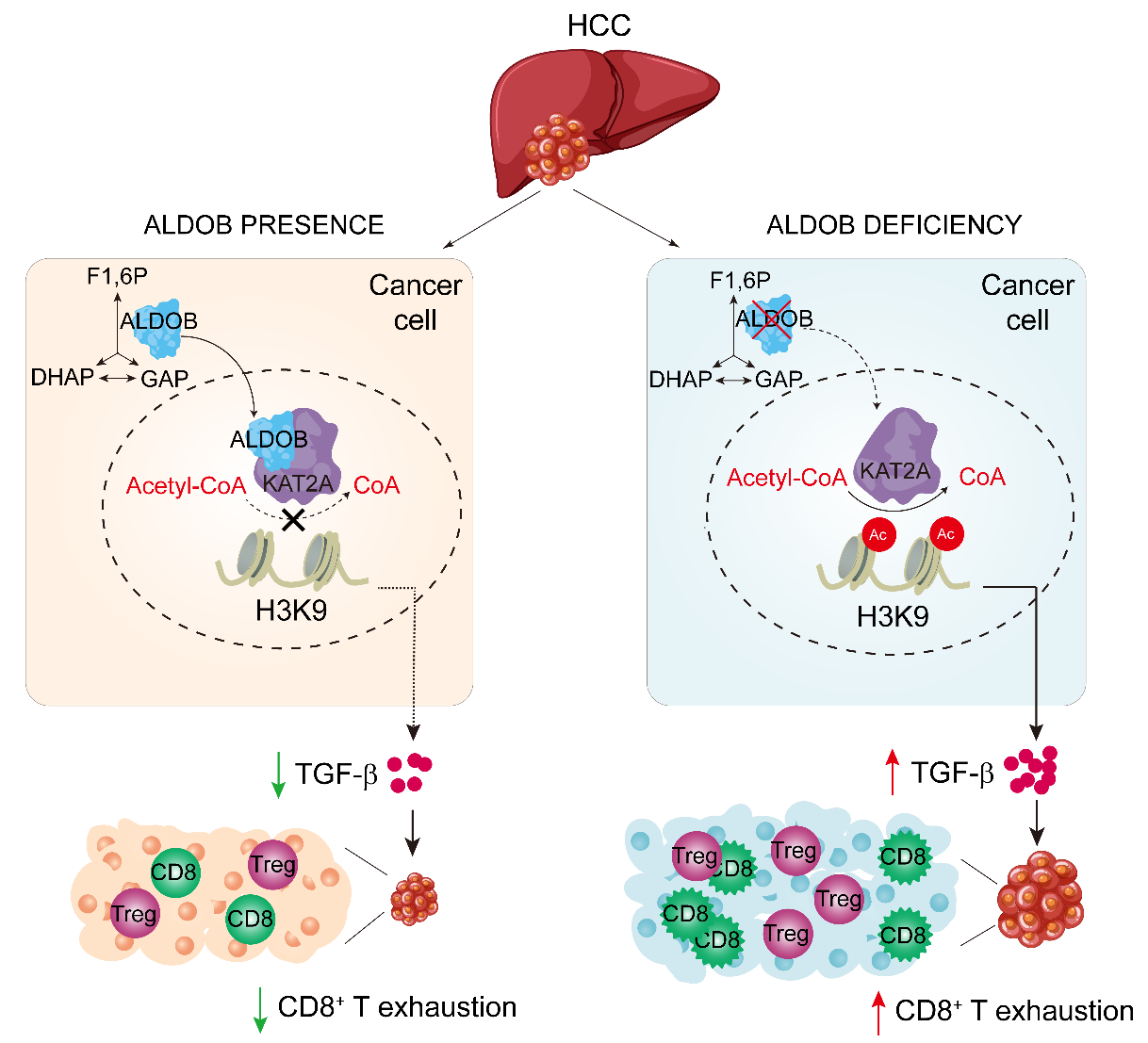
ALDOB通过KAT2A调控TGF-β转录表达进而影响HCC免疫微环境的机制图