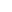骨髓“小工厂”新突破!Stem Cell Res Ther:基因改造基质细胞巧建仿生微环境,无需额外养料也能养好造血干细胞
发表时间:2025-07-24在血液疾病治疗领域,造血干祖细胞(HSPCs)基因疗法已展现出巨大潜力,比如CRISPR/Cas9-based HSPCs基因疗法获批用于镰状细胞病治疗。但目前HSPCs的体外培养仍面临难题:培养压力影响移植效果,外源性细胞因子补充又推高基因治疗产品成本。
近期,发表在Stem Cell Res Ther上的一项研究Engineering biomimetic bone marrow niche with gene modified mesenchymal stromal cells for ex vivo culture of human hematopoietic stem and progenitor cells为解决这些问题带来了新希望。

研究团队开发了一种基因修饰的人骨髓间充质干细胞(GM-MSCs),其能分泌干细胞因子(SCF)、血小板生成素(TPO)、FMS样酪氨酸激酶3配体(FLT3L)和白细胞介素3(IL3),可模拟骨髓细胞微环境来辅助HSPCs培养。
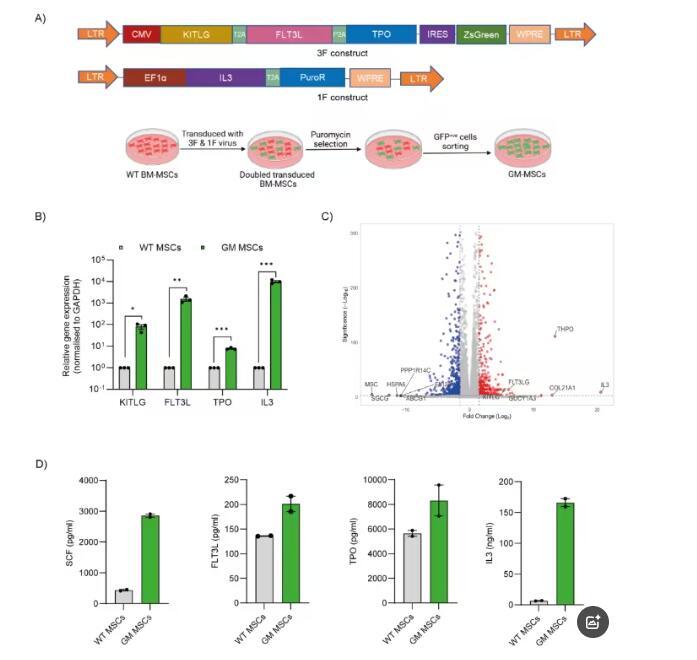
图 1:基因修饰间充质基质细胞(GM-MSCs)的生成与表征
在这种GM-MSCs的支持下,HSPCs的增殖效果与标准培养条件相当,且无需外部细胞因子补充。更重要的是,这些HSPCs能保留干细胞特性,包括集落形成能力、干性基因特征,以及在NBSGW小鼠体内长期多谱系重建的能力。同时,该仿生饲养层还能支持并减轻基于同源定向修复(HDR)的HSPCs基因编辑相关压力,这种基因编辑旨在重新激活胎儿血红蛋白,有望应用于β-血红蛋白病的基因治疗。
进一步研究显示,GM-MSCs分泌的四种细胞因子是HSPCs体外培养常用的补充因子,其分泌量经检测显著高于野生型间充质干细胞(WT-MSCs)。在与HSPCs的共培养中,当MSCs与HSPCs比例为4:10时,无需外源性细胞因子补充,HSPCs的扩增水平就能达到标准培养水平。而且,无论在常氧还是低氧条件下,GM-MSCs组的绝对造血干细胞数量、CD34+CD90+细胞的扩增倍数、集落形成单位(CFU)计数及比例,都与标准培养和WT-MSCs加细胞因子的条件相当。小分子鸡尾酒RUS虽能在标准培养条件下增加CD34+CD90+造血干细胞的绝对数量,但在GM-MSCs培养的HSPCs中无此效果,这可能是因为MSCs的调节作用模拟了体内微环境,限制了细胞的绝对扩增,而标准培养条件缺乏这种调节,使得RUS能更显著地促进细胞扩增。此外,GM-MSCs培养的HSPCs中,原始造血干细胞(CD34+CD90+CD45RA?CD38?CD49f+)的数量与标准培养加RUS的条件相似,且GM-MSCs能轻度降低体外培养相关的活性氧(ROS)水平和细胞凋亡,对细胞周期无影响。
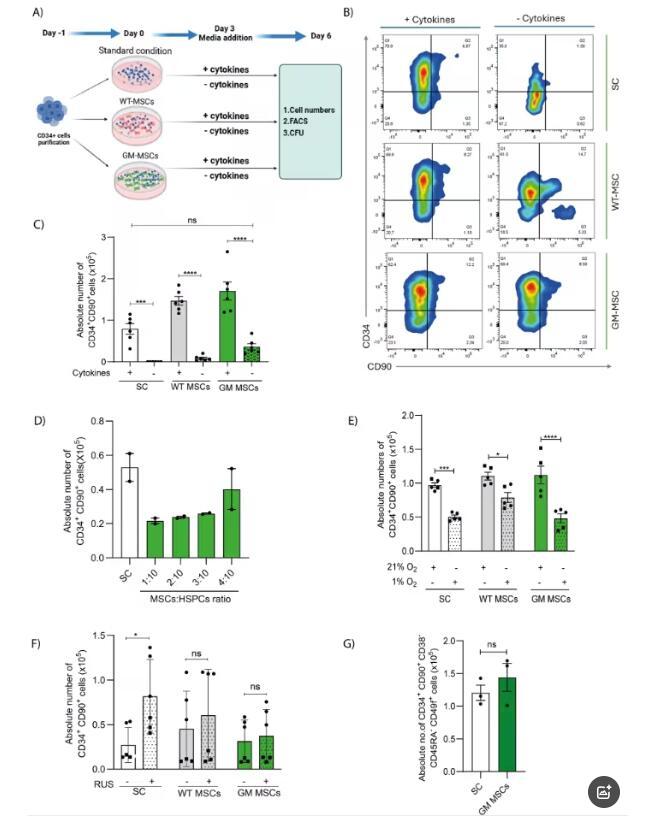
图 2:GM-MSCs无需外源性细胞因子即可支持造血干祖细胞
转录组分析表明,与标准培养相比,GM-MSCs共培养的HSPCs有1210个基因差异表达,其中911个上调,299个下调。上调基因涉及细胞粘附、干细胞维持等功能,富集在细胞外基质组织、细胞迁移调节等通路;下调基因则与钙内流、免疫反应分子介导等相关。基因集富集分析显示,上皮-间质转化(EMT)相关基因集显著富集,且上调基因中有249个在骨髓间充质干细胞来源的外泌体中特异性富集,提示GM-MSCs可能通过细胞外囊泡对HSPCs产生有益影响。同时,GM-MSCs共培养的HSPCs还保留了长期重建造血干细胞(LT-HSC)的特性。
体内移植实验中,经GM-MSCs共培养的HSPCs在NBSGW小鼠的骨髓、外周血和脾脏中,植入效率与标准培养和WT-MSCs共培养的HSPCs相当,CD34+细胞的频率在各组织中也保持一致,并且能在骨髓中实现T细胞、B细胞、髓系细胞和红细胞的多谱系重建。
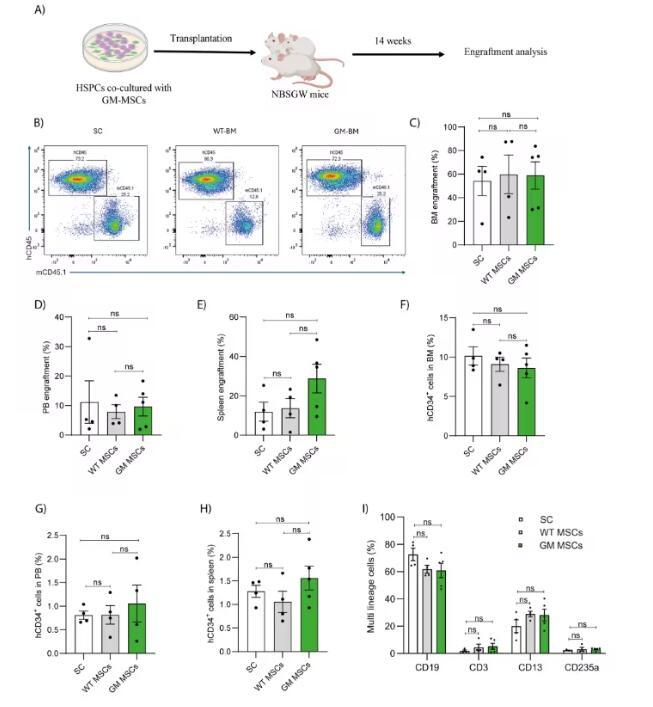
图 3:与GM-MSCs共培养的造血干祖细胞在体内保持植入潜力
在HDR基因编辑方面,GM-MSCs共培养的HSPCs整体HDR效率接近WT-MSCs组,绝对HDR阳性细胞数量是标准培养组的2倍,能有效支持基因编辑细胞的扩增,同时减轻ssODN和AZD-7648处理相关的毒性。虽然GM-MSCs组的胎儿血红蛋白(HbF)阳性细胞比例高于标准培养组,但低于WT-MSCs组,不过其编辑后的HSPCs中活性氧水平低于标准培养组,这可能是HDR阳性细胞活力提高的原因之一。
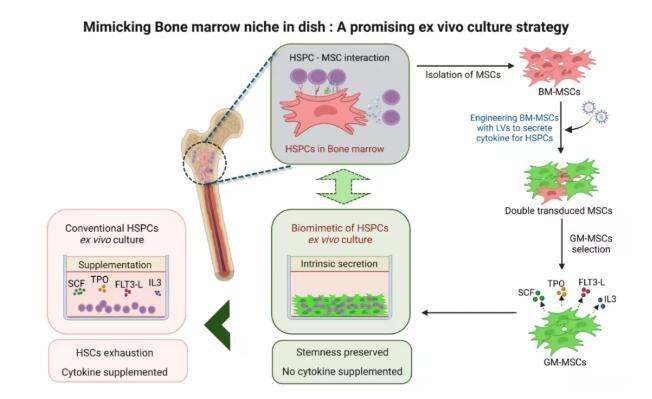
图 4:本研究的图解摘要
综上所述,这项研究开发的GM-MSCs通过建立仿生骨髓微环境,为传统细胞因子补充提供了一种有吸引力的替代方案,既能促进HSPCs扩增,又能维持其干性。这一发现凸显了工程化间充质干细胞在革新HSPCs体外培养方面的潜力,有望最终提高其在基因治疗应用中的治疗价值,为血液疾病的基因治疗开辟了更广阔的前景。对于患者而言,这意味着未来可能有更高效、低成本且安全的治疗选择,进一步推动基因治疗在临床的应用和普及。