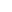庄小威最新Science论文:揭示神经元膜骨架由钙信号驱动的持续性动态重塑
发表时间:2025-08-13超分辨率成像技术揭示,神经元中的膜骨架呈现一种周期性结构:肌动蛋白丝在神经突的圆周上形成间距均匀的环形结构,相邻环形通过血影蛋白四聚体相互连接。这一高度有序的网络结构被称为膜相关周期性骨架(membrane-associated periodic skeleton,MPS),广泛存在于不同类型的神经元中且具有跨物种保守性。它在多种神经元功能中发挥关键作用,既可作为信号传导平台,又可为轴突提供机械支撑。
关于膜相关周期性骨架(MPS)的一个重要问题是其是否具有动态性,以及若存在动态性,这种动态是否对神经元功能至关重要。细胞骨架结构在稳定性与可塑性之间展现出一种有趣的二元性:既要满足持久功能需求(例如提供机械支撑),又要保持重塑能力以适应细胞不断变化的需求。
在涉及强烈外部刺激(例如 GPCR 激活、轴突变性过程或突触活动被激发)的特定情况下,MPS 可被主动降解。尽管这些观察表明 MPS 在特殊条件下具备重塑能力,但传统观点普遍认为其具有稳定结构。
2025 年 8 月 7日,哈佛大学庄小威团队在国际顶尖学术期刊 Science 上发表了题为:The membrane skeleton is constitutively remodeled in neurons by calcium signaling 的研究论文。
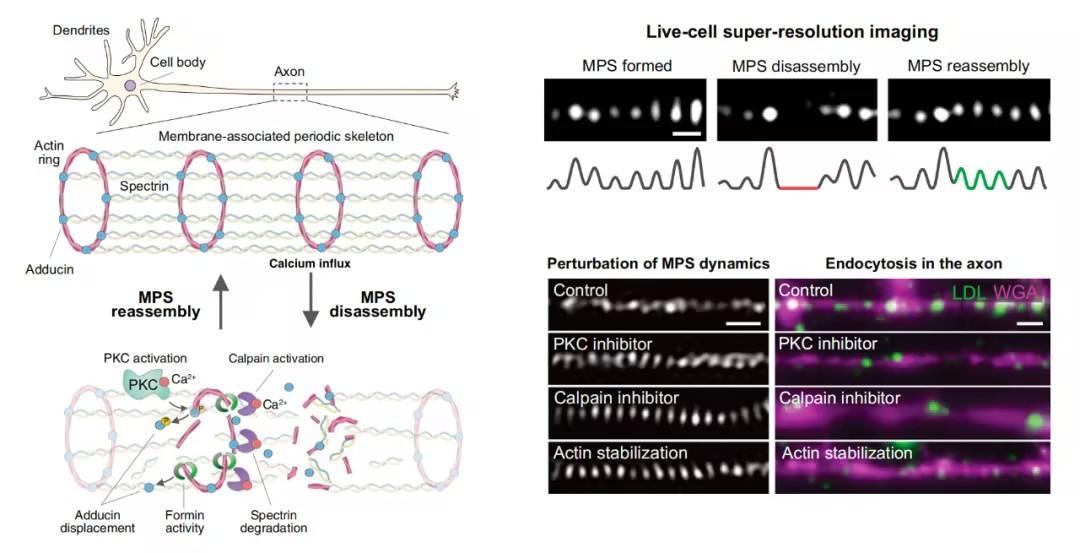
该研究通过活细胞超分辨率成像技术揭示了膜相关周期性骨架(MPS)的动态特性——该结构可沿轴突发生持续性的解体-重组循环。机制研究表明,MPS 重塑受钙离子调控,涉及肌动蛋白稳定性调控、钙蛋白酶依赖性蛋白水解作用,以及蛋白激酶 C 介导的内收蛋白磷酸化过程。这些发现为理解细胞执行基本生命活动的分子机制提供了重要理论依据。

神经元中的膜骨架呈现周期性晶格结构:由内收蛋白(adducin)和原肌球调节蛋白(tropomodulin)封端的肌动蛋白丝沿神经突形成环形结构,并通过血影蛋白四聚体(spectrin tetramers)连接。这种膜相关周期性骨架(MPS)对多种神经元功能至关重要。
在这项最新研究中,研究团队采用活细胞结构光照明显微镜(structured illumination microscopy,SIM)探究膜相关周期性骨架(MPS)的动态特征及其对神经元核心功能的贡献机制。研究发现,MPS 普遍存在动态行为特征:即使外界无刺激条件下,其特定区域仍会自发经历持续性的解体重组循环。为解析动态调控机制,研究团队通过多维度胞内信号通路研究,最终揭示了 MPS 重塑是由钙信号激活触发的酶促反应级联所驱动。
具体而言,钙离子(Ca2+)内流会激活蛋白激酶C(PKC),引发肌动蛋白封端蛋白(内收蛋白)的磷酸化,从而降低肌动蛋白环的稳定性并促进 MPS 解体。同时,钙离子可激活钙蛋白酶(calpain)介导血影蛋白降解。肌动蛋白聚合调控因子(成蛋白,Formin)通过取代肌动蛋白环上的内收蛋白参与动态调控,进一步促进 MPS 结构解聚。该研究发现,神经元活动可增强 MPS 动态性,且功能层面上 MPS 动态显著促进轴突内吞作用。这些结果表明,MPS 的存在可能抑制需要膜接触或形变的细胞活动,因此必须通过临时性局部解体的方式为这类过程提供空间,同时又不影响其执行其他功能的能力。
总的来说,该研究研究揭示了膜相关周期性骨架(MPS)的动态本质:在看似稳定的结构框架下,其持续经历着反复的局部分解与重构过程。MPS 动态特性由钙信号驱动,通过激活多信号通路协同作用的级联反应实现。这种动态特性不仅促进内吞作用,还可能支撑其他需膜接触或形变的生理过程。此外,MPS 动态还可通过调控膜受体分布来影响膜信号传导。目前,关于MPS重塑与神经元活动间的互作机制,仍是亟待解决的重要科学问题。