新闻咨询/ News
TTYH2与APOE介导的内体脂质转运机制:阿尔茨海默病相关脂代谢新靶点的发现
发表时间:2025-06-27
在神经系统中,脂质代谢紊乱与阿尔茨海默病等神经退行性疾病密切相关。作为大脑中主要的载脂蛋白,APOE(载脂蛋白E)的E4亚型是阿尔茨海默病最强的遗传风险因子,但其致病机制尚未完全阐明。长期以来,科学界对APOE介导的脂质转运过程认知存在关键空白:虽然APOE与细胞表面低密度脂蛋白受体(LDLR)的结合已明确,但脂蛋白被内吞后如何从内体释放脂质的分子机制仍是未解之谜。

瑞士苏黎世大学Raimund Dutzler团队在《Nature》发表的研究,首次揭示了跨膜蛋白TTYH2(Tweety同源蛋白2)作为APOE在内体中的关键相互作用伙伴,通过独特的结构机制促进脂质转运。这一发现不仅填补了细胞内脂质代谢通路的空白,更为了解APOE亚型差异性功能提供了结构基础。
研究团队运用多项前沿技术:
1)合成纳米抗体筛选技术鉴定TTYH2特异性结合配体;
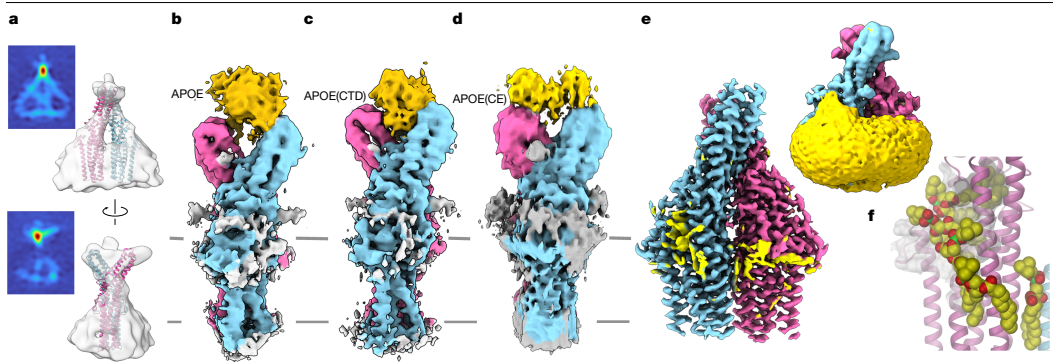
2)冷冻电镜解析TTYH2-APOE复合物三维结构(最高分辨率2.7)
3)单分子力谱(SMFS)定量相互作用动力学参数;
4)荧光共振能量转移(FRET)构建脂质转运功能验证体系;
5)亚细胞分级结合免疫印迹确定共定位特征。
主要研究发现:
-
TTYH2-APOE特异性互作鉴定
通过内源性蛋白pull-down联合质谱分析,首次发现APOE是TTYH2的天然配体。亚细胞分级实验证实二者共定位于内体区室,免疫荧光显示其与内体标志物Rab9共定位。单分子力谱测得结合解离常数koff≈1s-1,证明存在生理相关性的相互作用。

-
结构机制解析
冷冻电镜结构显示,TTYH2通过胞外域双体界面间的疏水腔结合APOE羧基端(CTD),而非已知的APOE-NTD受体结合域。该结合模式使脂蛋白颗粒定向靠近TTYH2的跨膜脂质通道,形成"膜-蛋白-脂蛋白"三联体结构。高分辨率结构(2.7?)首次捕捉到TTYH2跨膜腔中17个磷脂分子的连续分布,揭示其介导脂质重排的分子基础。

-
功能验证
构建含85%DPPC(二棕榈酰磷脂酰胆碱)的脂质体模型,发现TTYH2使NBD标记磷脂酰乙醇胺(PE)的转运速率提升14倍。这种促进作用具有亚型特异性,TTYH3仅显示基础活性。细胞实验证实内化的荧光标记PE与TTYH2存在共定位簇,支持其生理功能。
研究意义:
该研究确立了TTYH2作为首个被鉴定的内体脂质转运催化剂,完善了"APOE-LDLR内吞→TTYH2介导脂质释放→神经元脂质供给"的完整通路。特别值得注意的是,TTYH2结合APOE的CTD域而非NTD域,这意味着APOE2/3/4亚型在NTD的序列差异(如APOE4的Arg112)可能不影响TTYH2介导的脂质卸载,为解释APOE亚型选择性病理机制提供了新思路。在阿尔茨海默病中,TTYH2功能异常可能导致神经元脂质供给障碍,这为开发针对内体脂质转运环节的干预策略提供了潜在靶点。
研究还提出了TTYH蛋白家族的进化意义:其广泛存在于真核生物中的特征暗示这类膜蛋白可能构成了从酵母到人类保守的脂质转运基础机制。未来对TTYH1/3功能的研究,以及TTYH2在星形胶质细胞-神经元耦合中的具体作用,将成为神经脂质代谢领域的重要研究方向。(子科生物报道)